Therapie der Virushepatitis C
Die Therapie der chronischen Hepatitis C hat in den letzten Jahren deutliche Fortschritte erzielt. Es gibt immer mehr Hinweise, dass die dauerhafte Viruselimination die Entwicklung eines Leberzellkarzinoms reduziert und so die Prognose verbessert. Es konnte auch gezeigt werden, dass sich nach Viruselimination und Normalisierung der Leberwerte sogar die Leberhistologie verbessert. Grundsätzlich besteht eine Therapieindikation für alle HCV-Patienten mit chronischer Virämie, am dringlichsten für die Patienten, die ein erhöhtes Risiko für die Entwicklung einer Zirrhose haben oder von denen ein relevantes Übertragungsrisiko ausgeht.
In den letzten Jahren sind mit der Entwicklung neuer direkt antiviraler Substanzen (DAAs) die Heilungsraten (SVR, Sustained Virological Response) von 10% unter der Standard-Interferon (IFN)-Therapie zu Beginn der 1990er Jahre auf heute über 90-95% angestiegen sind [1,2].
Interferon-haltige Therapie-Schemata
Die duale Standardtherapie mit PEG-Interferon-α und Ribavirin wurde bis 2011 für alle HCV Genotypen eingesetzt [3,4]. Heute werden PEG-Interferon-α und Ribavirin primär in Kombination mit einer zusätzlichen direkt antiviralen Substanz (DAA) als sog. Triple-Therapie eingesetzt.
Mit der Zulassung der Proteaseinhibitoren Telaprevir (Incivo) und Boceprevir (Victrelis) für die Triple-Therapie kamen 2011 die ersten direkt aktiven antiviralen Substanzen (DAA) auf den Markt. Beide Substanzen sind ausschließlich für den Gebrauch bei Genotyp 1 Patienten zugelassen.Die Heilungsquoten bei Patienten mit Genotyp 1 stiegen mit Verfügbarkeit der Triple-Therapie auf etwa 70-75% an [1,2]. Patienten mit Leberzirrhose und einem Partial- bzw. Null-Response haben unter dieser Therapie allerdings ein deutlich reduziertes Ansprechen aufgewiesen (SVR 30-40%). Für die mittlerweile nur noch selten angewandte Therapie ist ein geschicktes Nebenwirkungsmanagement von entscheidender Bedeutung [2]. Häufig treten Blutbildveränderungen und gastrointestinale Nebenwirkungen wie Übelkeit oder Erbrechen auf. Für Telaprevir sind kutane Nebenwirkungen charakteristisch, die in Form eines (zumeist perianalen) Pruritus und vor allem eines typischen Exanthems (Rash) auftreten. Besondere Vorsicht ist in der Therapie von Patienten mit fortgeschrittener Leberzirrhose geboten, da hier hohe Raten schwerer Komplikationen und auch Todesfälle beschrieben wurden. Ebenso ist an dieser Stelle auf das hohe Interaktionspotential beider Proteaseinhibitoren der 1. Generation hinzuweisen, die über das zentrale Enzym CYP3A4 verstoffwechselt werden und mit einer Vielzahl an häufig verwendeten Medikamenten (z.B. Midazolam, Digoxin, Statine, Calciumantagonisten, Ciclosporin, Tacrolimus) teils massiv interagieren.
Interferon-haltige Therapie mit neuen DAAs
In den letzten Jahren wurden weitere direkt antivirale Substanzen in Kombination mit PEG-Interferon und Ribavirin zur Marktreife weiterentwickelt, wobei hier neben dem NS3A Proteaseinhibitor der 2. Generation Simeprevir vor allem der nukleosidische NS5B Polymeraseinhibitor Sofosbuvir zu nennen ist.
Sofosbuvir (Sovaldi) weist gegenüber den NS3 Proteaseinhibitoren der 1. Generation als Charakteristika eine pan-genotypische Wirksamkeit (Genotyp 1 bis 6), eine hohe Resistenzbarriere, eine gute Verträglichkeit sowie ein geringeres Interaktionspotential auf und muss nur in einer Einmaldosierung (400mg Tablette) verabreicht werden. Sofosbuvir erzielt in Kombination mit PEG-Interferon und Ribavirin bei Genotyp 1 Patienten SVR-Raten von bis zu 90%, beim Genotyp 2 und 3 wurden sogar ohne Interferon bis zu 78% der Patienten geheilt [2]. Für die Patienten mit Genotyp 2 und 3 Infektion wurde damit im Januar 2014 erstmals ein effektives rein orales Therapieregime verfügbar. Für therapie-naive Genotyp 2 oder 3 Patienten konnte mit einer 12-wöchigen Kombinationstherapie aus Sofosbuvir plus Ribavirin ein identisches Therapieergebnis (SVR 67%) zum derzeitigen Standard (PEG-Interferon/Ribavirin über 24 Wochen) belegt werden. Die höchsten Erfolgsraten mit ca. 95% SVR können bei Patienten mit Genotyp 2 erzielt werden, während die Aussichten beim Genotyp 3 mit ca. 60% deutlich niedriger liegen. Eine Leberzirrhose erweist sich insbesondere bei Patienten mit Genotyp 3 als ungünstiger Prädiktor (SVR ca. 20%). Ebenso ist ein früheres Nichtansprechen mit der Notwendigkeit einer Re-Therapie insbesondere bei Genotyp 3 mit einer im Vergleich zu Genotyp 2 geringeren Heilungsrate verbunden. Eine auf 24 Wochen verlängerte rein orale Therapie mit Sofosbuvir und Ribavirin steigert bei Genotyp 3 Non-Respondern die SVR von 30 auf 87% (therapie-erfahrene Zirrhose-Patienten 60%), während Genotyp 2 Patienten auch mit der kürzeren 12 Wochen Therapiedauer vergleichbar gute Ergebnisse um 90% SVR aufweisen. HCV Genotyp 3 Patienten weisen unabhängig von einer Zirrhose mit einer 12-wöchigen Sofosbuvir Triple-Kombination mit PEG-Interferon und Ribavirin vergleichbar gute Ergebnisse auf (SVR 83%).
Für Patienten mit HCV Genotyp 1 und 4 haben sich die Therapiemöglichkeiten seit Mai 2014 mit der Zulassung von Simeprevir (Olysio) in Triple-Kombination mit PEG-Interferon und Ribavirin nochmals erweitert. Simeprevir weist als Proteaseinhibitor der 2. Generation in einer Einmaldosierung (150mg Tablette) mit einer SVR um 80% eine weiter gesteigerte Effektivität im Vergleich zur Vorläufergeneration auf. Allerdings sind sie Ergebnisse für Zirrhose-Patienten auch für diese Kombinationstherapie unbefriedigend (SVR 58-65%). Es besteht eine deutlich bessere Verträglichkeit, wobei Simeprevir weiterhin in geringem Maße die Substanzklassen-typischen kutanen Nebenwirkungen aufweist. Es besteht eine Zulassung für HCV Genotyp 1 und 4. Für therapienaive Patienten und Relapse- Patienten beträgt die Therapiedauer 24 Wochen (12 Wochen Triple-Therapie gefolgt von 12 Wochen dualer Therapie mit PEG-Interferon und Ribavirin), für vorherige Non-Responder (einschließlich partieller und Null-Responder) 48 Wochen (12 Wochen Triple-Therapie gefolgt von 36 Wochen dualer Therapie mit PEG-Interferon und Ribavirin). Wenn eine Triple-Kombination mit PEG-Interferon und Ribavirin bei HCV-Genotyp-1a-Patienten erwogen wird, sollen die Patienten vor Behandlungsbeginn auf das Vorliegen von Viren mit NS3 Q80K-Polymorphismus getestet werden.
Rein orale Interferon-haltige Therapie mit neuen DAAs
Ziel der weiteren Therapieentwicklung ist die rein orale Therapie für Patienten mit allen HCV Genotypen. Wie viele direkt antiviral aktive Substanzen (DAA) kombiniert werden müssen, und welche Substanzklassen am besten kombiniert werden können, hängt von den jeweiligen Kombinationspartnern ab (Abb. 2). Aus der heutigen Datenlage zeichnet sich ab, dass Ribavirin für die meisten Patienten bald verzichtbar sein wird und abhängig vom Therapieschema nur für Patienten mit ungünstiger Ausgangslage (z.B. HCV Genotyp 1a, Zirrhose) weiterhin Bestandteil der Kombinationstherapie bleiben wird. Sehr ermutigend sind hohe Heilungsraten auch bei Genotyp 1 Null-Respondern auf die 1. Generations-Tripletherapie. Durch den Wegfall der limitierenden Interferon-Komponente und sehr günstige Nebenwirkungsprofile werden mit den rein oralen Therapiekombinationen nun auch Zirrhosepatienten im fortgeschrittenen Stadium behandelbar.
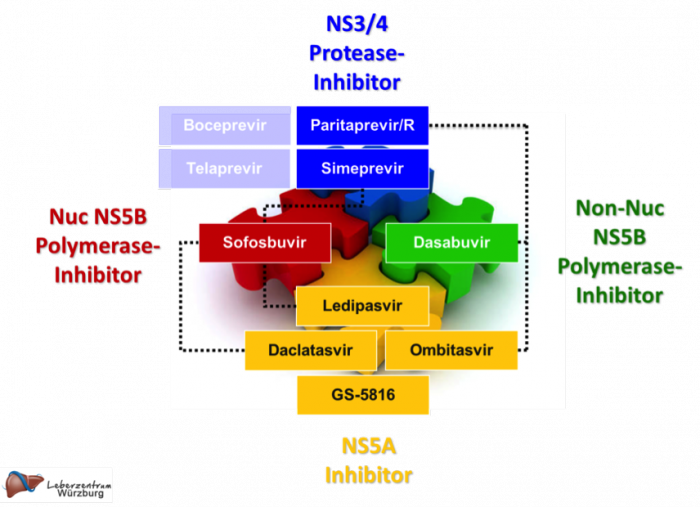
Abb. 2: Direkt antiviral aktive Substanzen Stand Dezember 2014. Kombinationen sind mit Verbindungslinien gekennzeichnet.
Für Patienten mit HCV Genotyp 1 und 4 steht mit der Zulassung von Simeprevir (Olysio) seit Mai 2014 unabhängig von vorherigen Behandlungen eine rein orale Kombinationstherapie zur Verfügung, allerdings mit relevanten Einschränkungen in der Zulassung. Simeprevir sollte in Kombination mit Sofosbuvir (Sovaldi) (sog. COSMOS-Kombinationsschema) nämlich nur bei Patienten angewendet werden, bei denen Interferon nicht geeignet ist oder die es nicht vertragen und bei denen eine Behandlung dringend ist. Basierend auf einer klinischen Bewertung jedes einzelnen Patienten kann Ribavirin hinzugefügt werden. Die empfohlene Behandlungsdauer beträgt 12 Wochen. Basierend auf einer kleinen Fallzahl der klinischen Phase II Studie liegt das Therapieansprechen unabhängig von einer Zirrhose bei 93-96% SVR. Aufgrund der derzeit noch eingeschränkten Datenlage kann über die optimale Therapie bei Zirrhose-Patienten bezüglich Therapiedauer und Ribavirin-Effekt keine abschließende Aussage getroffen werden. Es ist darauf hinzuweisen, dass bei starker Leberfunktionseinschränkung im Stadium Child-Pugh C mit einer deutlich erhöhten Exposition von Simeprevir zu rechnen ist.
Im August 2014 wurde mit Daclatasvir (Daklinza) der erste NS5A Inhibitor auf dem Europäischen Markt zugelassen. Daclatasvir, das als Einmalgabe in einer Standarddosierung von 60mg eingenommen wird, weist eine hohe antivirale Effektivität für HCV Genotyp 1 und 4 auf. Basierend auf einer kleinen Fallzahl der klinischen Phase II Studie liegt das Therapieansprechen in Kombination mit Sofosbuvir (Sovaldi) bei einer SVR über 90%. Ergebnisse bei Zirrhose-Patienten liegen für diese Kombinationstherapie bisher nicht vor. Es besteht eine gute Verträglichkeit. Die Zulassung sieht für Patienten mit HCV Genotyp 1 oder 4 ohne Zirrhose in Kombination mit Sofosbuvir eine Therapiedauer von 12 Wochen vor, bei Vorliegen einer Zirrhose 24 Wochen. Aufgrund der derzeit noch eingeschränkten Datenlage kann über die Bedeutung einer Ribavirin-Kombination keine abschließende Aussage getroffen werden. Patienten mit HCV Genotyp 4 können alternativ auch mit einer Triple-Kombination mit PEG-Interferon und Ribavirin über 24-48 Wochen (abhängig vom frühen virologischen Ansprechen zur Woche 4) behandelt werden. Für Daclatasvir in Kombination mit Sofosbuvir besteht auch eine Zulassung zur Therapie von Patienten mit HCV Genotyp 3, allerdings mit der relevanten Einschränkung auf Patienten mit einer kompensierten Zirrhose und / oder erfolgloser Vorbehandlung. Neueste Studiendaten belegen eine hervorragende Wirksamkeit von 94% SVR bei therapie-erfahrenen Patienten ohne Zirrhose, während Zirrhose-Patienten mit 58-69% SVR ein suboptimales Therapieansprechen aufweisen.
Basierend auf drei abgeschlossenen Phase III Studien zum NS5A-Inhibitor Ledipasvir wurde im November 2014 erstmals eine Fix-Kombination zweier DAAs zugelassen. Ledipasvir und Sofosbuvir (Harvoni) wird als fixed-dose 90mg/400mg Filmtablette einmal täglich eingenommen. Es besteht eine gute Verträglichkeit. Patienten mit HCV Genotyp 1 oder 4 ohne Zirrhose werden entsprechend der Fachinformation für 12 Wochen behandelt, Patienten mit kompensierter Zirrhose für 24 Wochen. Für Patienten ohne Zirrhose kann bei einer Ausgangs-Viruslast unter < 6 Millionen I.E./ml eine Therapieverkürzung auf 8 Wochen in Betracht gezogen werden. Für Patienten mit dekompensierter Zirrhose bzw. vor oder nach Lebertransplantation wird eine Therapiedauer von 24 Wochen unter Hinzunahme von Ribavirin empfohlen. Da Ledipasvir auch eine antivirale Aktivität gegen HCV Genotyp 3 aufweist, besteht für diese Patienten eine Zulassung, falls eine Zirrhose und/oder Versagen einer vorherigen Behandlung vorliegt. In der Fachinformation wird eine Therapiedauer von 24 Wochen ohne Ribavirin empfohlen.
Mit der Kombination von Paritaprevir (ABT-450; NS3A Proteaseinhibitor der 2. Generation) geboostert mit Ritonavir plus Dasabuvir (ABT-333; nicht-nukleosidischer NS5B Polymeraseinhibitor) plus Ombitasvir (ABT-267; NS5A Inhibitor) wird im Januar 2015 erstmals einer Dreifach-Kombination von DAAs zugelassen werden. Mit diesem sog. „3D-Schema“ konnten mit und ohne Ribavirin 96-100% der Genotyp 1 Patienten (Therapienaive und Null-Responder) innerhalb von 12 bzw. 24 Wochen geheilt werden. Für HCV Genotyp 1a Patienten wird die Wirksamkeit durch Hinzunahme von Ribavirin optimiert. Die 3D-Kombination weist bekannte Interaktionen mit verschiedenen häufig verwendeten Arzneimitteln auf, unter anderem mit den Immunsuppressiva Cyclosporin und Tacrolimus. Wie für alle in dieser Übersicht erwähnten Medikamente empfiehlt es sich daher unbedingt, die Begleitmedikation über computerbasierte Algorithmen (z.B. www.hep-druginteractions.org) zu kontrollieren. Für Cyclosporin und Tacrolimus sind entsprechende Dosisanpassungen bei Patienten nach Lebertransplantation etabliert. Ein Spezifikum dieser 3D-Kombination ist, dass alle drei Substanzen über die Leber eliminiert werden, so dass sich eventuell erstmals auch Therapieoptionen für Patienten mit hochgradig eingeschränkter Nierenfunktion ergeben könnten.
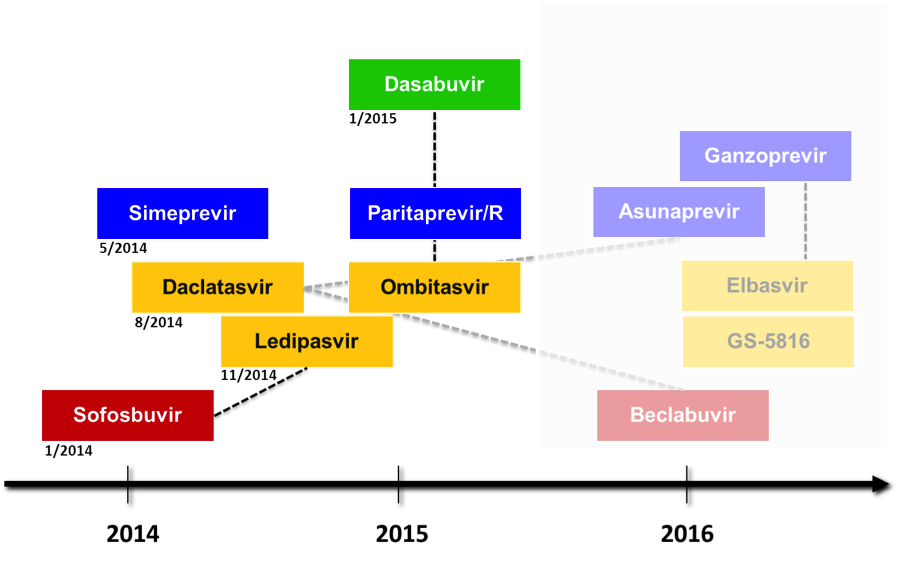
Viele weitere orale Kombinationstherapien werden derzeit in klinischen Phase 3-Studien untersucht, unter anderem die Kombination Daclastavir (NS5A Inhibitor) plus Asunaprevir (NS3A Proteaseinhibitor) plus Beclabuvir (NS5B Polymeraseinhibitor) sowie die Kombination Ganzoprevir (NS3A Proteaseinhibitor) plus Elbasvir (NS5A Inhibitor). Der NS5A Inhibitor GS-5816 scheint Ledipasvir in seiner Wirksamkeit vor allem bei Patienten mit HCV Genotyp 3 überlegen zu sein und wird derzeit in Kombination mit Sofosbuvir untersucht. Mit der Zulassung dieser zusätzlichen Interferon-freien Kombinationen wird allerdings frühestens für 2016 gerechnet.
Abb. 3: Direkt antiviral aktive Substanzen in der Entwicklung. Die in Studien untersuchten Kombinationen sind mit Verbindungslinien gekennzeichnet.
Eine ausführliche Beschreibung der Therapie-Leitlinien und Therapiealgorithmen findet sich in den jeweils aktuellen EASL, AASLD und DGVS Guidelines.
Im Würzburger Leberzentrum steht die Virushepatitis C seit jeher auch im Mittelpunkt der klinischen Forschung. Die Lebensqualität und die Behandlung der therapie-assoziierten Nebenwirkungen, insbesondere Fatigue und Depression ist bereits seit Jahren Gegenstand intensiver Forschung vor Ort. Erst kürzlich wurde aus unserer Klinik beschrieben, dass die neurokognitive Funktion nach erfolgreicher Viruselimination verbessert wird (6).
Ein Polymorphismus (genetische Variation) im Bereich des Interleukin-28B (IL28B) Gen ist mit erhöhten SVR-Raten unter der PEG-Interferon / Ribavirin Standardtherapie bei HCV Genotyp 1 Patienten assoziiert (7). Da der individuelle Vorhersagewert aber gering ist kann eine generelle Testung derzeit nicht empfohlen werden und sollte ein ungünstiger Befund auch nicht als Entscheidungsgrundlage gegen eine Therapie verwendet werden, wenn diese anderweitig dringlich indiziert ist.
Auch genetische Variationen am Ribavirin-Transportereiweiß haben einen Einfluss auf Nebenwirkungen und Therapieerfolg (8). Ähnliche Befunde wurden auch für ein Enzym des Ribavirin-Stoffwechsels im den roten Blutkörperchen erhoben (7,8).
Interessanterweise scheint Vitamin D (und genetische Varianten im Vitamin D-Rezeptor Gen) auch einen Einfluss auf den Therapieerfolg bei chronischer Hepatitis C zu nehmen (9). Die Supplementierung mit Vitamin D könnte hier günstige Effekte haben. Aktuelle Daten unserer Arbeitsgruppe belegen auch, dass der bei chronischen Lebererkrankungen häufige Vitamin D-Mangel mit einer rascheren Fibroseprogressionsrate vergesellschaftet ist (5).